どんな研究?
DNAは、生物の設計図ともいえる遺伝情報を持っており、その情報は塩基配列として記録されています。この塩基配列はメッセンジャーRNA(mRNA)にコピーされ、mRNAの情報をもとにタンパク質が作られます。mRNAワクチンは、COVID-19パンデミックでその有用性が示された医薬品ですが、病原体のタンパク質をコードした mRNA を投与し、体内で病原体のタンパク質を作らせるものです。このタンパク質が抗原として免疫応答を引き起こし、効率的に病気の予防や治療を行うことができます。これは、私たちの体に備わっている免疫システムをうまく利用した方法です。しかも、多くの免疫細胞が集まる脾臓にmRNAを届けることで、免疫の効率を高めることが期待されていますが、これを正確に制御することは難しいという課題がありました。
mRNAは、体内で容易に分解されてしまいます。そのため、狙った場所に届けるためには、脂質や高分子で保護をしたナノ粒子にする必要があります。しかし、ナノ粒子の成分によっては血液中の成分と結合して、肺の血管を詰まらせてしまうリスクがあります。また、血液中の成分と結合することで、ナノ粒子の機能が損なわれてしまいますそこで、これらを克服するために、医薬品の安定化などにも使われるポリエチレングリコール(PEG)で粒子表面を覆って投与する方法が開発されましたが、PEGが粒子を覆う度合い(密度)の調整が難しく、脾臓に到達しても免疫細胞と粒子が結合できないという問題点がありました。
総合研究院 難治疾患研究所 先端ナノ医工学分野の内田智士教授らの研究チームは、脂質や高分子を用いたナノ粒子とは異なる全く新しい手法として、mRNAとPEGを結合させた物質の設計に取り組みました。そして、PEG密度を調整し、脾臓にmRNAを効率よく届ける新しい方法を開発しました。
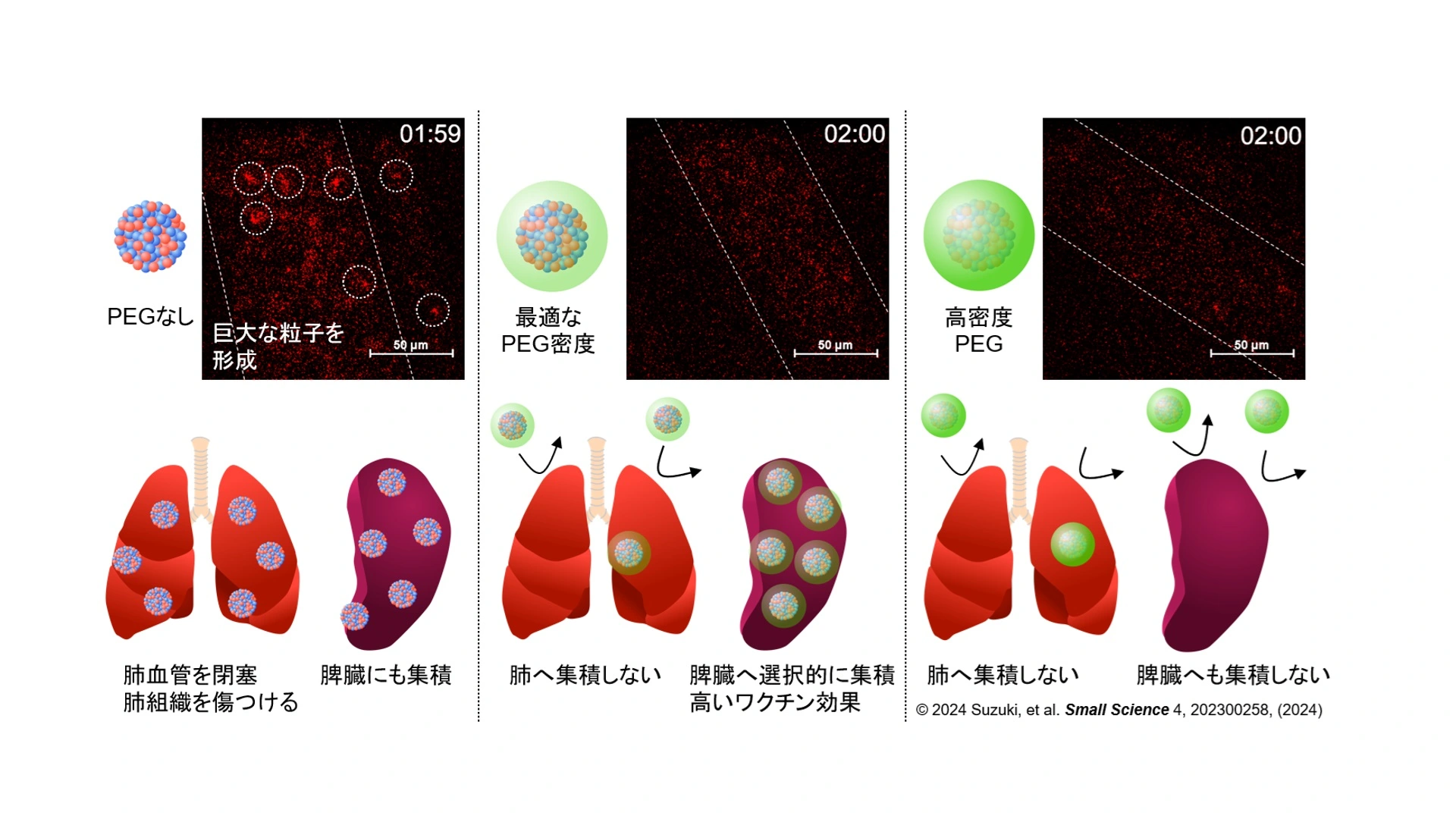
イラスト内の写真は、血管内のナノ粒子(赤い蛍光部分)を示す。(左)PEGなしの場合、血管内でナノ粒子が巨大な粒子を形成している。結果的に、標的組織である脾臓にmRNAを届けることができるものの、肺血管を閉塞して肺組織を傷つけてしまう。また、(中)最適なPEG密度の場合、血管内での巨大な粒子の形成は見られず、肺血管を閉塞せず、mRNAが脾臓に選択的に届く。(右)高密度PEGの場合、巨大な粒子の形成や肺血管の閉塞は見られないが、mRNAは脾臓への取り込みがうまくいかない。
ここが重要
この技術の鍵となるのが「PEG-RNA」です。これは、人工的に合成した短いRNAにPEGを結合させた物質です。PEG-RNAとワクチンにしたいmRNAを混ぜると、狙った数だけPEG-RNAが結合したmRNAを作ることができます。つまり、PEG密度の調整が可能になったのです。その結果、脾臓に届いたmRNAが免疫細胞と狙い通り結合できるようになりました。さらにワクチンの機能評価では、免疫の一種である細胞性免疫が強く誘導されていることも分かりました。
今後の展望
今後、研究チームはこの手法の安全性と有効性をさらに検証し、実用化に向けた研究を進める予定です。さらに今回強く誘導された細胞性免疫はがん治療においても有効な治療方針の一つであり、がんワクチンの開発にも応用が期待されます。
研究者のひとこと
これまで、脂質や高分子を用いたナノ粒子開発が行われてきましたが、mRNAの設計に注目した研究はほとんどありませんでした。今回の研究成果が、より安全で効率的なmRNA治療の実現につながることを期待しています。

この研究をもっと詳しく知るには
お問い合わせ先
研究支援窓口
- 備考
- お問い合わせは https://www.rdc.isct.ac.jp/contact/ からご連絡ください。


